L’essentiel
- À la suite d'un phénomène excitotoxique, toutes les fibres du nerf auditif se déconnectent des cellules ciliées internes touchées.
- Après 20 semaines, on retrouve une activité normale des fibres. Pourtant le nombre de fibres a chuté de 40 %.
- Cette compensation est permise par l’émergence d’une nouvelle classe de fibre, dont l’hyperactivité pourrait être à l’origine des acouphènes et de l’hyperacousie.
Aujourd'hui, quelle est la théorie dominante concernant les acouphènes ?
Tout comme la douleur, les acouphènes sont avant tout un symptôme. Leurs causes et les mécanismes sous-jacents peuvent donc varier considérablement d'une personne à l'autre. Néanmoins, un consensus se dégage : les acouphènes résultent d'une activité nerveuse anormale qui se propage le long de la voie auditive jusqu'au cortex cérébral, où elle est interprétée comme un bruit désagréable, voire insupportable.
Comment ça fonctionne ? Il est important de souligner que, dans la grande majorité des cas (environ 80 %), les acouphènes sont associés à une surdité. En cas de perte auditive périphérique, touchant l'oreille interne ou le nerf auditif, le cerveau peut augmenter son gain pour tenter de compenser la diminution des signaux entrants. Mais un gain central excessif ou mal régulé peut déclencher des acouphènes et de l'hyperacousie. C'est la théorie du gain central.
Votre équipe a récemment mené des travaux, publiés dans PNAS [1], qui vont à l’encontre de cette théorie.
Soyons clairs, nos recherches ne contredisent pas l'idée d'un rôle central du cerveau dans les acouphènes. Néanmoins, nous estimons que cette explication mérite d'être élargie en considérant l'implication des fibres nerveuses du nerf auditif, responsables de la transmission des informations sonores de l'oreille au cerveau. Contrairement à une intuition première, une perte de connexion nerveuse, ou déafférentation, n'entraine pas nécessairement une diminution des entrées sensorielles. Au contraire, nos travaux mettent en évidence que les fibres nerveuses restantes présentent une augmentation de leur activité qui pourrait à elle seule rendre compte de l'hypersensibilité aux sons (hyperacousie) et/ou de la perception de sons fantômes (acouphènes) chez certains individus. En d'autres termes, limiter l'explication des acouphènes au seul concept de gain central apparait trop restrictif. Il serait plus pertinent d'envisager le terme de gain neuronal qui engloberait l'ensemble du système auditif, depuis la cochlée jusqu'aux centres nerveux cérébraux.
Audiologie-Demain-3838.jpg)
Initialement, vos travaux ne portent pas sur l’acouphène, mais sur l’excitotoxicité et le comportement des synapses et des fibres du nerf auditif lorsque ce phénomène se produit. Quel est le lien avec les acouphènes ?
Notre laboratoire se consacre depuis de nombreuses années à l'étude de l'impact du bruit sur l'activité des fibres du nerf auditif. Nous avons été les premiers à montrer qu'un traumatisme sonore entraine une perte de connexions entre les cellules sensorielles de l'oreille interne. Ce phénomène résulte d'une libération excessive de glutamate par ces mêmes cellules. L'accumulation de ce neurotransmetteur au niveau des terminaisons nerveuses des fibres – les synapses – induit une toxicité, un processus désigné sous le terme d'excitotoxicité. Le lien entre l’excitotoxicité et les acouphènes réside dans l’hyperactivité des fibres du nerf auditif après ce phénomène toxique.
C’est-à-dire ?
À la suite d’un phénomène excitotoxique, nous observons l'émergence d'une nouvelle classe de fibres à basse activité spontanée présentant des seuils d’activation et des indices de synchronisation comparables aux fibres à haute activité spontanée. Ce résultat est surprenant car il contredit la corrélation négative habituellement observée entre le seuil d'activation et l'activité spontanée des fibres du nerf auditif chez les animaux témoins. En règle générale, plus l'activité spontanée d'une fibre est faible, plus son seuil d'activation (audiométrique) est élevé, et inversement.
Et donc c’est ce phénotype original qui pourrait expliquer les acouphènes ou d’autres phénomènes d’hyperactivité des voies auditives, comme l’hyperacousie ?
Absolument. L'hypothèse dominante suggère que les acouphènes et/ou l'hyperacousie découlent d'une augmentation de l'activité spontanée et d'une synchronisation accrue des décharges neuronales tout au long de la voie auditive. Or, c'est précisément ce que nous observons après excitotoxicité : une augmentation globale de l'activité spontanée des fibres du nerf auditif et des indices de synchronisation supérieurs à la normale, en particulier pour les fibres présentant initialement une faible activité de base.
Quelles expériences avez-vous menées pour parvenir à ce résultat ?
Afin d’étudier les capacités intrinsèques des neurones à établir de nouvelles synapses fonctionnelles, nous devions nous affranchir de l'impact direct du bruit sur les cellules ciliées. C’est ainsi que nous avons choisi de simuler une libération excessive de neurotransmetteurs en appliquant du kainate (un analogue du glutamate) au niveau de la fenêtre ronde de la cochlée de gerbilles. Les résultats de cette manipulation ont révélé une abolition de l’activité des fibres du nerf auditif, preuve d’une déafférentation complète des cellules ciliées. Cependant, cette activité est progressivement redevenue normale au cours des 20 semaines suivant l'application du kainate, comme en témoignaient le seuil et l’amplitude du potentiel d’action composite (PAC) du nerf auditif, équivalent à l’onde I des potentiels évoqués auditifs (PEA). De la même manière qu’à la suite d’un traumatisme acoustique, la réparation synaptique s'est avérée incomplète : 20 semaines après l'administration de kainate, on dénombrait seulement 60 % des synapses. Nous avons enregistré l’activité unitaire des fibres « reconnectées » aux cellules ciliées. La proportion des fibres à faible activité spontanée avait drastiquement diminué et l’activité spontanée était en moyenne supérieure à la normale. Autre résultat marquant, les fibres présentant les activités spontanées les plus faibles (< 18 potentiels d’action/sec) avaient des indices de synchronisation comparables aux fibres à hautes activités spontanée. Il s’agissait donc bien d’une nouvelle classe de fibres.
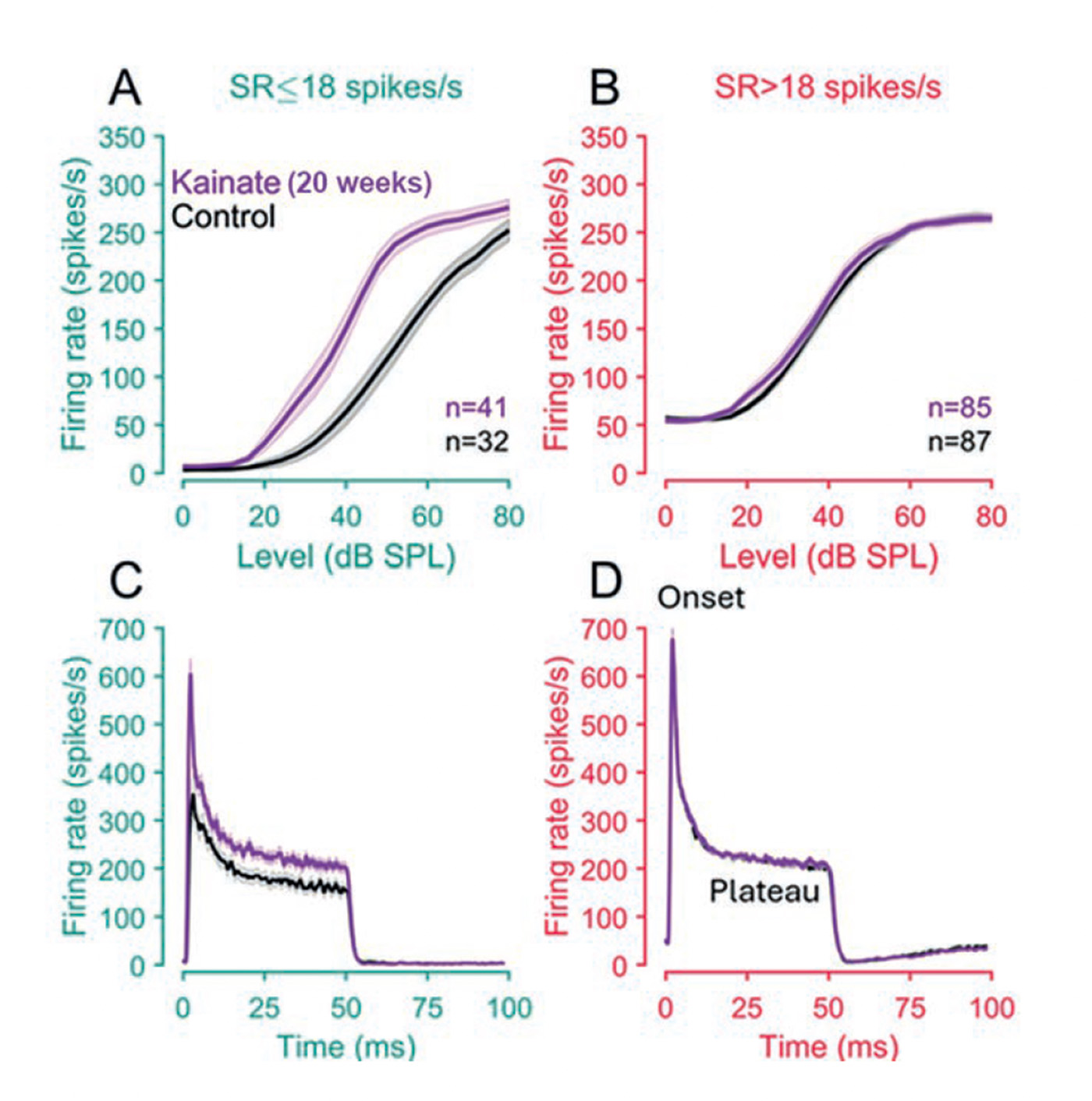
Est-ce que vos observations, réalisées sur un modèle animal et avec un certain type de protocole (excitotoxicité induite par kainate) sont extrapolables ?
En théorie, toute atteinte à la cochlée susceptibles de provoquer un dysfonctionnement des cellules ciliées internes et une libération excessive de glutamate au niveau de la synapse avec les fibres du nerf auditif est susceptible de déclencher des dommages excitotoxiques. C'est notamment le cas lors d'une exposition au bruit ou à certains médicaments ototoxiques, et bien sûr au cours du vieillissement qui provoque une perte progressive des synapses cochléaires. L'excitotoxicité pourrait également intervenir dans des contextes tels que les infections virales, les évènements vasculaires ou les processus inflammatoires affectant l'oreille interne.
D'un point de vue évolutif, quelle serait l’explication de ce changement phénotypique lors de la régénération des fibres ?
Tout au long de la vie, nous perdons inéluctablement des fibres du nerf auditif. Ce mécanisme d'amplification des signaux (hyperactivité des fibres) provenant de la cochlée, dès la première synapse, représente donc un mécanisme de compensation efficace face à ces pertes inévitables.
Qu’est-ce que ces travaux apportent sur le plan clinique ?
Le développement d'une thérapie efficace contre les acouphènes et l'hyperacousie demeure un enjeu majeur. Néanmoins, la compréhension des mécanismes excitotoxiques sous-jacents s'avère cruciale pour l'élaboration de traitements futurs. Jusqu’à présent, les stratégies thérapeutiques envisagées étaient basées sur l'utilisation de neurotrophines pour induire une repousse des fibres nerveuses auditives endommagées par le bruit. Or, nos travaux mettent en évidence que la régénération des fibres lésées ne garantit pas le rétablissement d'une activité normale. Par conséquent, une régulation de l'activité des synapses nouvellement formées est tout aussi indispensable pour espérer traiter efficacement les acouphènes et l'hyperacousie.
Sur la base de ces résultats/découvertes, quels travaux entreprenez- vous aujourd’hui ?
Cette recherche, initiée en collaboration avec Sharon Kujawa de l’université de médecine d’Harvard, ouvre des perspectives prometteuses. Nous poursuivons l’exploration des mécanismes pathologiques qui affectent les synapses. Nous avons notamment mis en évidence une corrélation entre les modifications de l'activité des fibres nerveuses et les changements morphologiques des synapses. En d'autres termes, la plasticité synaptique, que l'on pensait autrefois spécifique au système nerveux central, se manifeste également au niveau de la cochlée.
Une autre voie de recherche prometteuse concerne le développement d'outils de diagnostic innovants. Actuellement, notre compréhension de la composition du nerf auditif humain demeure lacunaire : nous ignorons la proportion des fibres à hauts et bas seuils d'activation, ainsi que les caractéristiques fonctionnelles intrinsèques de ces fibres, telles que leur activité spontanée et leur constante de temps. Une connaissance approfondie de la physiologie et de la pathologie du nerf auditif humain s'avère indispensable pour l'élaboration de thérapies ciblées et véritablement efficaces.
Login-AdobeStock-d8bf.jpg)


